 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
以2.0×10-2mol·L-1EDTA滴定同浓度的Zn2+,可采用两种方法。一是在pH=5.5的六亚甲基四胺缓冲溶液中,以二甲酚橙
以2.0×10-2mol·L-1EDTA滴定同浓度的Zn2+,可采用两种方法。一是在pH=5.5的六亚甲基四胺缓冲溶液中,以二甲酚橙(XO)为指示剂;二是在pH=10.0的氨性缓冲溶液中,其中游离氨的浓度为0.20mol·L-1,以铬黑T(EBT)为指示剂。试分别计算上述两种方法的终点误差各为多少?
(lgKZnY=16.5;pH=5.5时,lgαY(H)=5.5,pZnep(XO)=5.7;pH=10.0时,lgαY(H)=0.45,lgαZn(OH)=2.4,pZnep(EBT)=12.2;Zn2+-NH3络合物的lgβ1~lgβ4分别为2.37、4.81、7.31、9.46)
 答案
答案






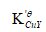 ,若以紫脲酸氨为指示剂(pH=10时,pCut=13.8),计算终点误差。
,若以紫脲酸氨为指示剂(pH=10时,pCut=13.8),计算终点误差。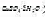 为0.005000g)返滴定,用去8.12mL.计算试样中Fe2O3,和Al2O3,的质量分数。
为0.005000g)返滴定,用去8.12mL.计算试样中Fe2O3,和Al2O3,的质量分数。




















