 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
25℃时,一元弱酸HA的标准解离常数试计算0.10mol·L-1HA溶液的pH和HA的解离度。
25℃时,一元弱酸HA的标准解离常数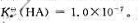 试计算0.10mol·L-1HA溶液的pH和HA的解离度。
试计算0.10mol·L-1HA溶液的pH和HA的解离度。
 答案
答案
 请输入或粘贴题目内容
搜题
请输入或粘贴题目内容
搜题
 拍照、语音搜题,请扫码下载APP
拍照、语音搜题,请扫码下载APP
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
25℃时,一元弱酸HA的标准解离常数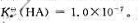 试计算0.10mol·L-1HA溶液的pH和HA的解离度。
试计算0.10mol·L-1HA溶液的pH和HA的解离度。
 答案
答案
 更多“25℃时,一元弱酸HA的标准解离常数试计算0.10mol·L-1HA溶液的pH和HA的解离度。”相关的问题
更多“25℃时,一元弱酸HA的标准解离常数试计算0.10mol·L-1HA溶液的pH和HA的解离度。”相关的问题
第1题
A.1.0X10-2
B.1.0X10-3
C.1.0X10-8
D.1.0X10-9
第2题
某一弱酸HA的标准解离常数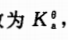 在水溶液中的解离度为α。若加等体积水稀释此洛液,则发生的变化是()。
在水溶液中的解离度为α。若加等体积水稀释此洛液,则发生的变化是()。

第3题
准确量取30.00 mL弱酸HA,加水稀释至100.00 mL,在电池:(—)SHE|HA || SCE()中,以0.100 0 mol·L-1NaOH标准溶液滴定之。25℃时,当弱酸HA被中和一半时,电池电动势为0.524 V,化学计量点时,电池电动势为0.749 V。求:(1)弱酸HA的电离常数Kα值。(2)原弱酸HA溶液的浓度?(已知饱和甘汞电极的电极电位为0.244 V)
第5题
测得下述电池的电动势为0.672 V,Pt,H2(0.101 MPa),HA(0.200 mol.L-1),NaA(0.300 mol.L-1)∥SCE计算HA的解离常数。(已知EscE=0.242 V。)
第6题
有一弱酸HA,其离解常数Ka=6.4×10-7,计算c(HA)=0.30mol·L-1时溶液的c(H+)。
第8题
由一元弱酸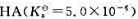 和它的共轭碱NaA组成的缓冲溶液中,HA的浓度为0.25mol·L-1.若在100mL此缓冲溶液中加入5.0mmolNaOH固体,溶液的pH变为5.60。计算加入NaOH固体前缓冲溶液的pH.
和它的共轭碱NaA组成的缓冲溶液中,HA的浓度为0.25mol·L-1.若在100mL此缓冲溶液中加入5.0mmolNaOH固体,溶液的pH变为5.60。计算加入NaOH固体前缓冲溶液的pH.
第9题
强碱(酸)滴定一元弱酸(碱),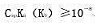 就可以直接准确滴定。如果用K表示滴定反应的形成常数,那么该反应的
就可以直接准确滴定。如果用K表示滴定反应的形成常数,那么该反应的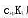 应为多少?
应为多少?
第10题
解热镇痛药阿司匹林(乙酰水杨酸)是一元弱酸,其结构式为
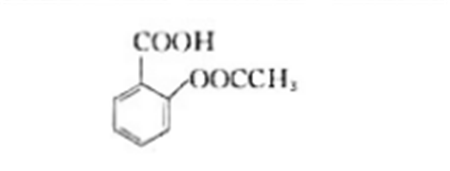 已知阿司匹林的pH:为3.50,服用后以未解离的分子在胃中被吸收。如果患者先吃了调节胃液酸度的药物,使胃液的pH保持在2.95.此时再吃两片阿司匹林(共含0.65g阿司匹林)。假如服用后阿司匹林立即溶解,且不改变胃液的pH,未解离的分子可完全被胃液所吸收,此时能被吸收的阿司匹林有多少克?
已知阿司匹林的pH:为3.50,服用后以未解离的分子在胃中被吸收。如果患者先吃了调节胃液酸度的药物,使胃液的pH保持在2.95.此时再吃两片阿司匹林(共含0.65g阿司匹林)。假如服用后阿司匹林立即溶解,且不改变胃液的pH,未解离的分子可完全被胃液所吸收,此时能被吸收的阿司匹林有多少克?
第11题
用0.1000mol·L-1NaOH溶液滴定50.00mL一元弱酸的数据如下:
(a)绘制滴定曲线;
(b)绘制 曲线;
曲线;
(c)用二级微商法确定终点;
(d)计算试样中弱酸的浓度;
(e)化学计量点的PH应为多少?
(f)计算此弱酸的电离常数(提示:根据滴定曲线上的半中和点的PH)。
| 体积/mL | pH |
| 0.00 1.00 2.00 4.00 7.00 10.00 12.00 14.00 15.00 15.50 15.60 15.70 15.80 16.00 17.00 20.00 24.00 28.00 | 3.40 4.00 4.50 5.05 5.47 5.85 6.11 6.60 7.04 7.70 8.24 9.43 10.03 10.61 11.30 11.96 12.39 12.57 |